Le moteur à cycle de dissolution d’ammoniac
Dr. Ing. STRUL Salomon
En préambule de l’article présent nous donnons quelque propriétés physico-chimiques des substances que nous utilisons par la suite dans l’exposé.
- L’Eau (H2O) masse molaire 18g/mole
Chaleur spécifique 1 Kcal/kilogramme pour monter la température de 1°K.
Comme 1 Kcal vaut 4.18 KJoules, il faut 4.18 KJ pour chauffer un kg d’eau de 1°K.
Une mole d’eau vaut 18g d’eau donc la chaleur spécifique est 75.4 J/mole d’ H2O
H2 + ½ O2 = H2O + 237kj/mole
Chaleur de formation d’une mole d’eau : 237 KJ de dégagement de chaleur par combustion de deux moles d’hydrogène avec une demi-mole d’oxygène.
- L’ammoniac (NH3) différent de l’ammoniaque (NH4OH) ou hydroxyde d’ammonium
Masse molaire NH3 17g/mole et NH4OH 35g/mole
Chaleur de formation (endothermique) -80.7 KJ/mole
Chaleur de dissolution de l’ammoniac dans l’eau : 2000kj/kg
En fait c’est la chaleur de formation du NH4OH plus la chaleur de dissolution :
H2O + NH3 = NH4OH + 70 KJ/mole (2000KJ/kg)
La réaction chimique de combinaison de l’eau avec l’ammoniac fournit 332kj/mole
Chaleur spécifique de l’ammoniaque, 37 J/mole,
Nettement plus petite que l’eau qui est de 75.5 J/mole
Nous supposons connu le fonctionnement d’un turboréacteur classique qui équipe les avions dits « à réaction ».
Nous rappelons brièvement qu’il y a un compresseur rotatif qui comprime l’air atmosphérique à une pression fixée à l’avance et qu’on injecte de façon homogène du combustible dans le courant d’air crée par le compresseur. Le combustible est allumé et vu l’arrivée d’air il augmente la chaleur du mélange (l’enthalpie) et le volume initial et conduit le débit d’air ainsi augmenté vers une turbine qui se trouve sur le même axe que le compresseur. Donc la turbine qui devient motrice, entraîne le compresseur et il y a un amorçage du système qui se perpétue de la sorte jusqu’à l’arrêt d’arrivée de combustible où le tout s’arrête.
Un premier corolaire de ce qu’on vient d’expliquer c’est qu’un turboréacteur à l’arrêt ne démarre pas tout seul !
En effet il faut un courant d’air assez important pour faire brûler le combustible et faire tourner la turbine qui va en retour faire tourner le compresseur.
Dans les avions modernes, sur l’axe du turboréacteur se trouve encore un moteur électrique qui à partir de batteries électriques va démarrer le compresseur et va amorcer le système avant que celui-ci ne devienne indépendant. Ensuite le moteur est débranché et le turboréacteur est auto-entretenu.
La turbine à gaz du réacteur fournit la puissance nécessaire au fonctionnement de l’ensemble du système. Cela signifie que tous les accessoires d’un avion prennent leur source d’énergie à partir de la turbine, notamment la pressurisation de la cabine et les autres engins fonctionnant dans l’avion.
Malheureusement tout cela a un coût !
Le compresseur est le plus gourmand et il consomme environ 30% de la puissance délivrée à l’axe par la turbine. Donc la puissance disponible au réacteur est nettement plus faible que la puissance installée et cela de plus de 30% !
Nous avons imaginé un système qui récupère la puissance du compresseur en utilisant d’autres principes que la compression !
Pour cela nous faisons appel à des propriétés physico-chimiques de l’ammoniac (NH3) et de l’eau (H2O)
L’ammoniac a une forte affinité pour l’eau liquide et cela en fonction de la température du milieu de réaction.
Sous pression ambiante, à 0°C ou 273.15°K un litre d’eau dissout 1050 litres d’ammoniac gazeux.
Si vous essayez de comprimer un volume de 1050 litres de gaz pour le ramener à un volume d’un litre vous devez comprimer le gaz 1050 fois (loi de BOYLE-MARIOTTE pour les gaz parfaits ce qui est approximativement le cas ici)
Or ce travail de dissolution se fait non seulement en ne dépensant aucun travail mais en libérant une grande chaleur, capable de faire bouillir le litre d’eau dans lequel on veut dissoudre les 1050 litres d’ammoniac.
Il faut donc refroidir le dispositif pendant la dissolution pour éviter une explosion !
Imaginons donc que nous sommes en possession de ce litre d’eau qui contient en solution 1050 litres d’ammoniac.
La, physico-chimie nous apprend qu’à 100°C ou 373,15°K un litre d’eau dissout 0 litres d’ammoniac.
Donc le litre d’eau contenant 1050 litres d’ammoniac libère tout l’ammoniac à 100°C et si l’espace est fermé la pression augmente dangereusement !
Notre dispositif fonctionne donc entre 0°C et 100°C. Le rendement de l’installation ne peut être déterminé par le principe de Carnot simple puisqu’il n’est pas purement thermodynamique, faisant intervenir des phénomènes chimiques et de dissolution.
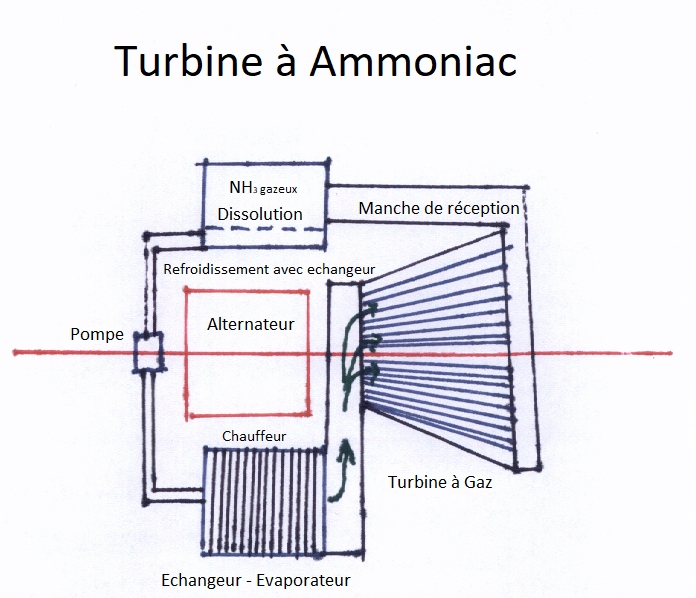
Donc on imagine aisément un moteur fonctionnant de la façon théorique suivante :
Un axe contient une petite pompe à liquide délivrant un faible volume de solution d’eau avec ammoniac gazeux dissout à 1050 litres par litre d’eau dans un échangeur qui est chauffé de l’extérieur. Le type de source de chaleur n’est pas encore important mais il peut être diversifiée !
Le liquide chauffé libère l’ammoniac gazeux qui est dirigé vers une turbine à gaz, NH3 en l’occurrence. Celle-ci se trouve sur le même axe qu’un alternateur et que celui qui entraîne la petite pompe à solution aqueuse avec l’ammoniac dissout.
Le cycle démarre de lui-même dès qu’on allume le chauffage de l’échangeur. La mise en route n’est pas immédiate vu qu’il faut un certain temps pour chauffer de l’eau, donc ce dispositif est bon pour des installations fixes à fonctionnement permanent comme des centrales électriques ou des bateaux mais moins indiqué pour des voitures. Notons que le gaz qui sort de la turbine a fourni du travail, donc est refroidi par le double effet de détente et de libération de travail. Il est donc à nouveau soluble dans l’eau et prêt à chauffer la solution d’eau.
Pour éviter l’échauffement excessif, il peut passer par l’échangeur situer derrière la petite pompe à liquide et participer à l’échauffement de la solution qui va libérer le gaz pour la turbine. Ce procédé, récupère les 30% d’énergie prise par le compresseur pour fournir le gaz chaud à la turbine à gaz. Par ailleurs, il récupère aussi une partie de la chaleur de dissolution et de réaction de l’eau et de l’ammoniac.
Il y a des problèmes soulevés par cette installation. Un problème important est celui de l’étanchéité. En effet, l’ammoniac est très fluide, plus léger que l’air et très toxique. Il s’agit donc de rendre les installations suffisamment étanches pour qu’il n’y ait pas de fuites détectables. En cas d’accident, la fuite d’ammoniac peut intoxiquer les personnes en contact et les brûler gravement, même de façon létale.
En revanche, toute l’installation travaille à moins de 100°C ce qui réduit le coût des matériaux et l’utilisation des plastiques permet de se passer de la plupart des pièces métalliques.
N’importe quel combustible peut servir à chauffer l’échangeur d’évaporation et la récupération de chaleur de la dissolution permet d’accroitre de façon significative le rendement de l’installation.
La production de CO2 dépend du combustible utilisé. Si l’on brûle de l’hydrogène, la production est nulle. Si l’on chauffe de façon électrique la production est également nulle. On peut utiliser une partie de la production d’électricité de l’installation pour le chauffage de l’échangeur d’évaporation. De la sorte, l’installation est autosuffisante.
Le gaz et l’eau de l’échangeur d’évaporation, à la sortie de la turbine devraient éventuellement être encore refroidis. Donc un échangeur-refroidisseur devrait être prévu pour évacuer les calories de l’eau et du gaz avant une nouvelle dissolution. Une éventuelle récupération de ces calories est à l’étude.
Le schéma de l’installation est reproduit ici-bas.